重组腺相关病毒基因编辑系统(AAV2)
AAVpro® CRISPR/Cas9 Helper Free System (AAV2) |
· 以病毒传递的方式导入Cas9基因和sgRNA,可以实现在难转染哺乳动物细胞中进行基因编辑,包括分裂细胞和非分裂细胞
· AAV病毒导入Cas9基因可以排除基因组整合和Cas9基因持续表达所带来的影响,降低脱靶效应
· 包装辅助质粒表达人microRNA miR-342有助于显著提高AAV病毒滴度
|
| |
| ■ 产品说明: |
我们可以提供两种CRISPR/Cas9 AAV2病毒粒子制备系统,无需辅助病毒,可采用Cas9进行基因编辑:AAVpro CRISPR/Cas9 Helper Free System和AAVpro CRISPR/SaCas9 Helper Free System。这两个试剂盒都可以用于将Cas9表达框和一个用户自定义的单向导RNA (sgRNA)导入至哺乳动物细胞中。Cas9基因序列来源于酿脓链球菌(Streptococcus pyogenes)或者金黄色酿脓葡萄球菌(Staphylococcus aureus)。AAV系统可用于广泛哺乳动物细胞类型,有效实现体外基因组修饰。CRISPR/Cas9系统采用两个AAV载体导入较大的S. pyogenes Cas9 (SpCas9),而由于SaCas9相对较小,CRISPR/SaCas9系统可以借助单个载体实现导入。sgRNAs可被直接一步克隆至预线性化的pAAV-Guide-it-Down或者pAAV-Guide-it-1质粒。无需辅助病毒,只需与试剂盒所包含的辅助质粒共转染HEK 293T细胞即可制备高滴度的AAV2病毒粒子。AAVpro CRISPR/Cas9 Helper Free System (Code No. 632608) 和AAVpro CRISPR/SaCas9 Helper Free System (Code No. 632619) 都是完整试剂盒,包含了sgRNAs克隆和AAV病毒粒子制备所需要的所有试剂。同样也包含了有效分离提取AAV2病毒粒子的AAV Extraction Solution。需要注意的是,SpCas9和SaCas9即使作用于基因组的同一区域,其靶向效率也是不同的–详细信息请见实验例。
|
| |
| AAVpro CRISPR/Cas9 Helper Free Systems (with S. pyogenes Cas9) |
· SpCas9基因被分成两段分别承载在pAAV-Guide-it-Up和pAAV-Guide-it-Down两个质粒上,两段SpCas9基因之间有1.6-kb的区域是同源的,同源区域在靶细胞中通过同源重组形成全长SpCas9基因
· SpCas9使用的前间区序列邻近基序(Protospacer Adjacent Motif,PAM)序列为NGG,其中N代表任意碱基-详细信息请见AAVpro CRISPR/Cas9 Systems使用手册
· 所提供的pAAV-Guide-it-Down质粒是预线性化的,有利于一步克隆sgRNAs,降低由于质粒自连所产生的背景
|
| |
| AAVpro CRISPR/SaCas9 Helper Free Systems (with S. aureus Cas9) |
· SaCas9基因组装在单个质粒pAAV-Guide-it-1上,同时也包含了sgRNA表达框
· SaCas9 (来自于金黄色酿脓葡萄球菌)使用的前间区序列邻近基序(Protospacer Adjacent Motif,PAM) 序列为NNGRR(T),其中N代表任意碱基,R代表A或者G碱基,(T)具有较强的偏好性-详细信息请见AAVpro CRISPR SaCas9 Systems使用手册
· 所提供的pAAV-Guide-it-1质粒是预线性化的,有利于一步克隆sgRNAs,降低由于质粒自连所产生的背景
|
| |
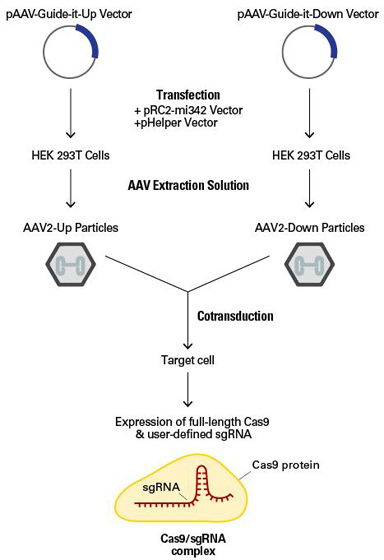 |
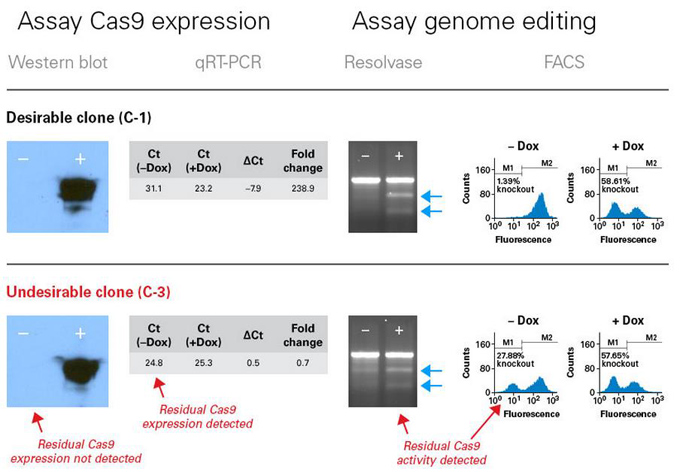
图1. 全长Cas9和sgRNA产生。
|
| |
pAAV-Guide-it-Up和pAAV-Guide-it-Down载体分别编码被删减的Cas9基因上游和下游部分,两者之间有1.6-kb同源重叠区域。将一个用户自定义的单向导RNA (sgRNA)克隆至pAAV-Guide-it-Down(见载体图谱)。pAAV-Guide-it-Up或者pAAV-Guide-it-Down与pRC2-mi342和pHelper载体共同转染HEK 293T细胞制备AAV2-Up或者AAV2-Down病毒。采用AAV Extraction Solution分离提取制备产生的病毒粒子。AAV2-Up和AAV2-Down病毒共转导靶细胞。AAV基因组处理过程中会在1.6-kb同源重叠区域发生同源重组,形成全长Cas9基因,转录并翻译成Cas9蛋白质。
|
| |
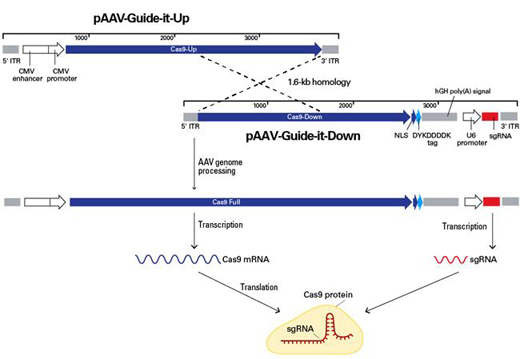 |
| 图2. AAV载体重组产生全长Cas9和sgRNA。 |
| |
Cas9基因较大导致不能将其包装至单个AAV病毒粒子中。pAAV-Guide-it-Up和pAAV-Guide-it-Down载体分别包含Cas9经过删减的上游和下游部分,这两部分之间具备1.6-kb同源重叠区域。采用两个质粒分别进行病毒包装制备病毒。制备完成的病毒共同转导靶细胞,通过同源重组形成全长Cas9基因(4.1 kb)。在靶细胞中表达的功能Cas9蛋白质由sgRNA导向至合适的基因型位点。
|
| |
 |
| 图3. pAAV-Guide-it-Up载体图谱。 |
| |
这是pAAV-Guide-it-Up载体的结构。这个载体包含在AAVpro CRISPR/Cas9 Helper Free System中,此系统用于制备AAV病毒粒子实现Cas9和sgRNA基因的细胞导入,这两者是进行CRISPR/Cas9基因编辑所必需的组分。由于Cas9基因较大,使得其不能包装在单个AAV病毒粒子中。为了可以实现AAV介导的Cas9基因的导入,此系统采用了两个单独的Cas9质粒。pAAV-Guide-it-Up载体包含一段被删减的Cas9基因上游部分(3,106 bp),由CMV启动子驱动编码Cas9 N端1,035个氨基酸。
|
| |
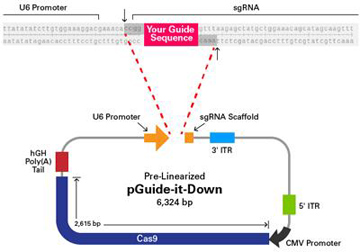 |
| 图4. pAAV-Guide-it-Down载体图谱。 |
| |
这是预线性化的pAAV-Guide-iT-Down载体的结构。这个载体包含在AAVpro CRISPR/Cas9 Helper Free system中,此系统用于制备AAV病毒粒子实现Cas9和sgRNA基因的细胞导入,这两者是进行CRISPR/Cas9基因编辑所必需的组分。由于Cas9基因较大,使得其不能包装在单个AAV病毒粒子中。为了可以实现AAV介导的Cas9基因的导入,此系统采用了两个单独的Cas9质粒。pAAV-Guide-it-Down载体包含了一段被删减的Cas9基因下游部分(2,616 bp),编码Cas9 C端872个氨基酸。一个用户自定义的单向导RNA (sgRNA)可被克隆至pAAV-Guide-it-Down载体中,位于人U6启动子的下游。要构建这个载体,需要先将作用于基因组靶位点的一对寡核苷酸链(向导序列)退火形成双链,然后将形成的双链DNA克隆至预线性化的载体中。
|
| |
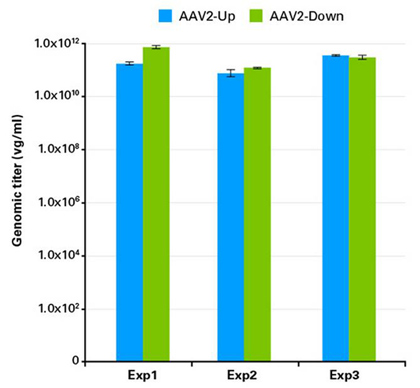 |
| 图5. HEK 293T细胞制备的AAV2-Up和AAV2-Down 病毒粒子的基因组滴度相同。 |
| |
采用AAVpro Extraction Solution从HEK 293T细胞中分离提取AAV2-Up和AAV2-Down病毒粒子(参考protocol overview)。采用AAVpro Titration Kit (for Real Time PCR)检测基因组滴度。3次平行实验的结果表明所获得的AAV2-Up和AAV2-Down基因组滴度相近。
|
| |
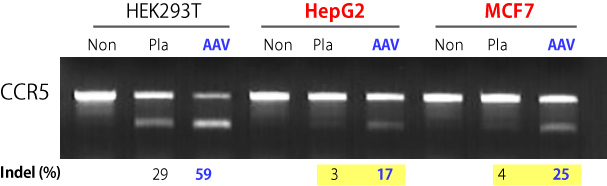 |
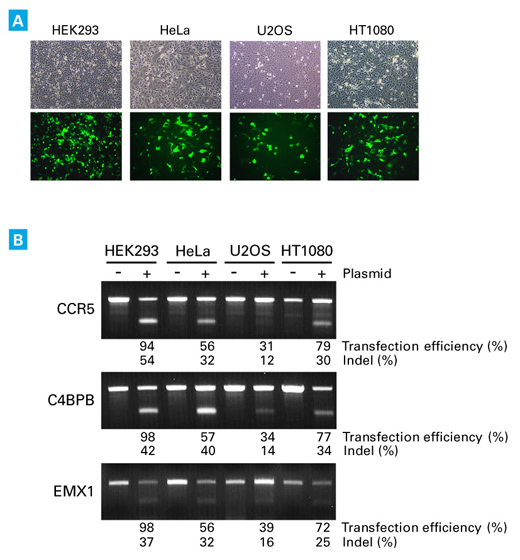
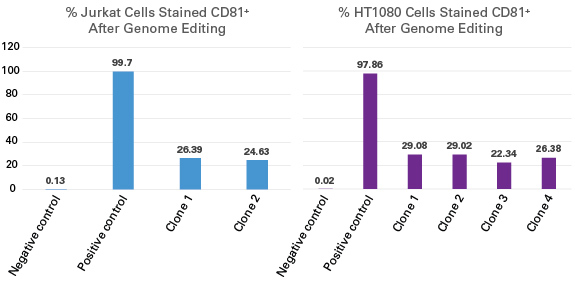
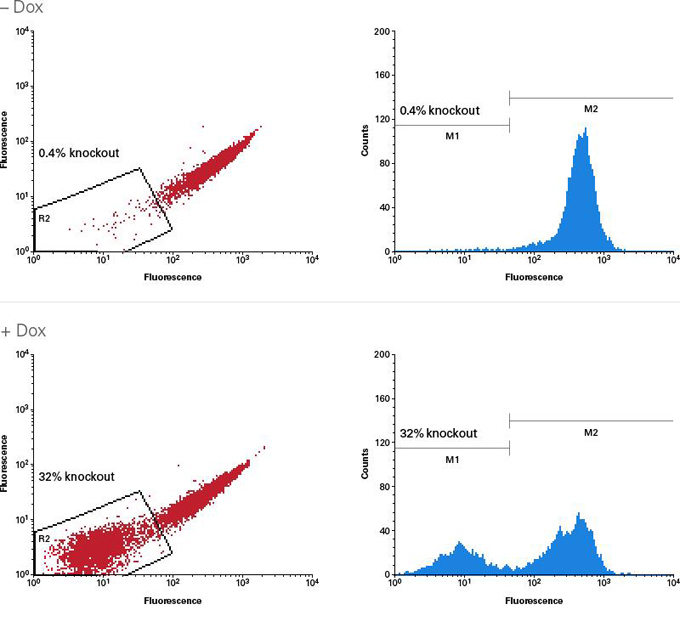
| 图6. 与质粒转染相比,尤其针对难转染的细胞系,AAVpro CRISPR/Cas9系统会产生更多的基因突变。 |
| |
转导前1天将所标注的细胞类型(1.0 x 105 cells)接种至12孔板中。作用于CCR5 基因的AAV2-Up和AAV2-Down病毒粒子以1.0 x 105 MOI(基因组滴度)转导靶细胞。72小时后,收集细胞并采用Guide-it Mutation Detection Kit进行分析。作为对照,采用Xfect Transfection Reagent转染编码Cas9和靶向CCR5基因的向导序列的质粒(P: 2.5 μg)至靶细胞。
|
| |
 |
| 图7. AAVpro CRISPR/SaCas9系统通过单个载体表达SaCas9和sgRNA。 |
| |
pAAV-Guide-it-1以预线性化形式提供,用于插入sgRNA靶序列(橘色标注部分为sgRNA)。采用此载体包装获得的病毒转导靶细胞时,靶细胞会同时表达进行基因编辑的SaCas9和sgRNA。
|
| |
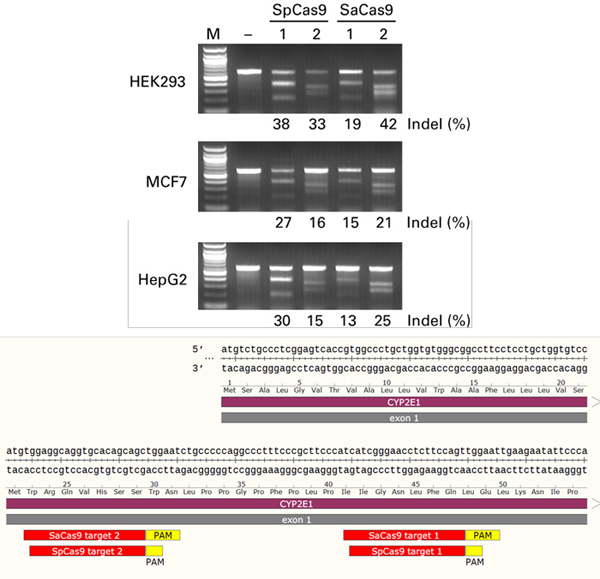 |
| 图8. Guide-it Mutation Detection Kit平行比较采用AAVpro CRISPR/Cas9 System (SpCas9)和AAVpro CRISPR/SaCas9 System产生的基因组修饰。 |
| |
以CYP2外显子1两个不同的基因组区域为靶位点,孔1和2显示每个酶的检测结果,凝胶图下面的图显示靶区域。每个细胞类型的突变百分比标注在每个孔下面。转导前1天将3种不同细胞系分别接种1 x 105个细胞至12孔板。采用两载体系统AAVpro CRISPR/Cas9 System (SpCas9)或者单载体系统AAVpro CRISPR/SaCas9 System制备的病毒粒子以1.0 x 105 MOI(基因组滴度)转导靶细胞。72小时后,收集细胞并采用Guide-it Mutation Detection Kit进行分析 。
|
| |
| ■ 产品组份 |
| AAVpro CRISPR/Cas9 Helper Free System (AAV2)(Code No. 632608) |
1. AAVpro CRISPR/Cas9 Vector Set
|
| pAAV-Guide-it-Up Vector |
500 ng/μl |
| pAAV-Guide-it-Down Vector(Linear) |
7.5 ng/μl |
|
2. Guide-it Ligation Components
|
| DNA Ligation Mighty Mix |
|
| Guide-it Oligo Annealing Buffer |
|
| Guide-it Control Annealed Oligos |
100 fmol/μl |
| Guide-it Sequencing Primer 1 |
100 pmol/μl |
| PCR-Grade Water |
|
3. Stellar Competent Cells(Code No. 636763)
|
4. pRC2-mi342 Vector(1 μg/μl)
|
5. pHelper Vector(1 μg/μl)
|
6. AAVpro Extraction Solution
|
| AAV Extraction Solution A |
1.5 ml×3 |
| AAV Extraction Solution B |
150 μl×3 |
| |
|
| AAVpro CRISPR/Cas9 Vector System(Code No. 632609) |
1. AAVpro CRISPR/Cas9 Vector Set
|
| 20 μl pAAV-Guide-it-Up Vector |
500 ng/μl |
| 20 μl pAAV-Guide-it-Down Vector(Linear) |
7.5 ng/μl |
|
2. Guide-it Ligation Components
|
| DNA Ligation Mighty Mix |
|
| Guide-it Oligo Annealing Buffer |
|
| Guide-it Control Annealed Oligos |
100 fmol/μl |
| Guide-it Sequencing Primer 1 |
100 pmol/μl |
| PCR-Grade Water |
|
3. Stellar Competent Cells(Code No. 636763)
|
|
| |
| AAVpro CRISPR/SaCas9 Helper Free System (AAV2)(Code No. 632619) |
| 1. pAAV-Guide-it-1 Vector (Linear) (7.5 ng/μl) |
20 μl |
|
2. Guide-it Ligation Components v3
|
|
| DNA Ligation Mighty Mix |
50 μl |
| Guide-it Oligo Annealing Buffer |
1.5 ml |
| Guide-it Control Annealed Oligos v3 (100 fmol/μl) |
10 μl |
| Guide-it Sequencing Primer 1 (100 pmol/μl) |
10 μl |
| PCR Grade Water |
1 ml |
|
3. Stellar Competent Cells(Code No. 636763)
|
| 4. pRC2-mi342 Vector(1 μg/μl) |
20 μl |
| 5. pHelper Vector(1 μg/μl) |
20 μl |
|
6. AAVpro Extraction Solution
|
|
| AAV Extraction Solution A |
1.5 ml×3 |
| AAV Extraction Solution B |
150 μl×3 |
| |
|
| AAVpro CRISPR/SaCas9 Vector System(Code No. 632618) |
| 1. pAAV-Guide-it-1 Vector (Linear) (7.5 ng/μl) |
20 μl |
|
2. Guide-it Ligation Components v3
|
|
| DNA Ligation Mighty Mix |
50 μl |
| Guide-it Oligo Annealing Buffer |
1.5 ml |
| Guide-it Control Annealed Oligos v3 (100 fmol/μl) |
10 μl |
| Guide-it Sequencing Primer 1 (100 pmol/μl) |
10 μl |
| PCR Grade Water |
1 ml |
|
3. Stellar Competent Cells(Code No. 636763)
|
| |
| ■ 保存 |
Stellar Competent Cells:-80℃
其它:-20℃
(AAVpro Extraction Solution溶解后置于室温保存)
|
| |
| |












.png)
.png)
.png)
.png)
.png)
.png)
.png)