Lenti-X CRISPR/Cas9 System是一个完整的由慢病毒介导的CRISPR/Cas9基因编辑系统。该系统包括Lenti-X Packaging Single Shots(用于产生高滴度的病毒)和两个不同的质粒载体(用于在靶细胞中表达Cas9 和客户自定义的sgRNA)。表达sgRNA的质粒系统pLVX-hyg-sgRNA1,易于插入客户自定义的sgRNA 序列,并且该系统提供足够的质粒供客户构建10种不同的sgRNA序列质粒。利用慢病毒导入sgRNA和Cas9基因,可以对难转染细胞系实现靶向基因编辑。
Lenti-X CRISPR/Cas9 System涉及到Cas9在靶细胞中的恒定表达,而Lenti-X Tet-On 3G CRISPR/Cas9 System结合了Tet-On 3G 反式转录激活蛋白,这使得用户可以通过添加强力霉素(doxycycline)来诱导Cas9的表达。通过严格控制Cas9的表达,Lenti-X Tet-On 3G CRISPR/Cas9 System可以使用户在细胞培养中,减少与Cas9稳定表达相关的毒性与脱靶效应。 |
| |
| ■ 产品特点 |
· 利用病毒导入Cas9 基因和sgRNA ,使得一些难转染的哺乳动物细胞可以实现基因编辑,包括增殖细胞和非增殖细胞。
· Lenti-X Packaging Single Shots易于产生高滴度病毒。
· 由慢病毒介导客户自定义的sgRNA 和Cas9,用于哺乳动物使用CRISPR/Cas9 技术进行基因编辑。
· 通过严格控制Cas9的表达,Lenti-X Tet-On 3G CRISPR/Cas9 System可以使用户在细胞培养中,减少与Cas9稳定表达相关的毒性与脱靶效应。
|
| |
| ■ 产品应用 |
· 利用CRISPR/Cas9技术对哺乳动物基因组编辑时,以慢病毒为基础的、用户自定义sgRNA和 Cas9的导入系统。
|
| |
| ■ 实验例 |
 |
| |
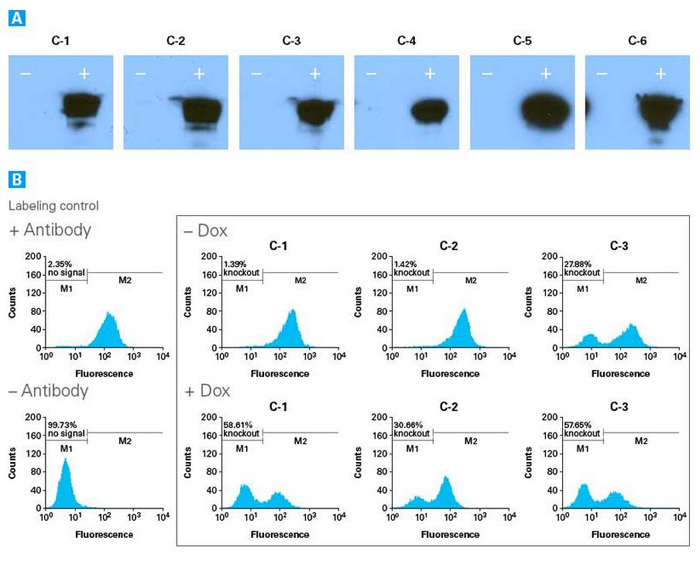
图1. 诱导敲除HEK293细胞中CD81基因
Tet-On 3G慢病毒转导靶细胞后采用G418筛选阳性单细胞克隆,选取24个单克隆分析荧光素酶报告基因的诱导表达倍数,选择荧光素酶报告基因背景量表达量最低的细胞克隆,然后以Cas9慢病毒(MOI=5)进行转导。转导后的靶细胞以1 μg/ml嘌呤霉素进行筛选,2周后,任意选择6个稳定细胞克隆分析Cas9的诱导表达倍数。将每个单克隆扩增培养的细胞分别接种至两个孔(12孔板)进行培养,其中一孔细胞添加0.5 μg/ml强力霉素诱导培养2天。采用抗Cas9的多克隆抗体(Code No. 632607)和ECL试剂通过Western blot分析Cas9诱导表达情况,抗体稀释比例为1:1,000。从中选取3个Tet-On 3G-Cas9-阳性细胞克隆(C-1, C-2和C-3)进行扩增培养并将其分别接种至2个孔(12孔板)中,CD81-sgRNA慢病毒(MOI=5)再次转导靶细胞,转导8小时后,添加0.5 μg/ml强力霉素至其中一孔进行诱导培养。6天后,收集细胞并采用FITC标记的抗人CD81抗体进行染色,通过FACS检测CD81表达情况。图A. Western blot检测结果显示了在添加0.5 μg/ml强力霉素(+)进行诱导或者不添加强力霉素(-)的情况下,6个分别独立的Tet-On 3G-Cas9-阳性细胞群Cas9蛋白质的表达情况。图B. FACS检测结果显示了CD81-sgRNA慢病毒转导的3个分别独立的Tet-On 3G-Cas9-阳性293T细胞群,在添加0.5 μg/ml强力霉素(+)进行诱导或者不添加强力霉素(-)的情况下,目的基因的敲除效率。在所检测的3个细胞群中,其中2个细胞群C-1和C-2在不添加强力霉素进行诱导的情况下基本不发生基因编辑现象,添加强力霉素进行诱导的情况下CD81基因的敲除效率分别为58.6%和30.7%。而另外一个细胞群C-3在不添加强力霉素进行诱导的情况下仍然会发生基因编辑现象,CD81基因的敲除效率为27.9%。 |
| |
 |
| |
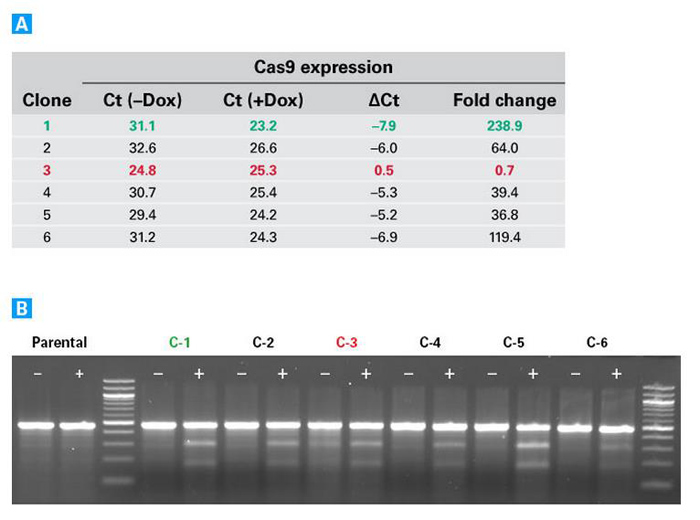
图2. 以可诱导的方式编辑HEK293细胞中AAVS1基因
通过qRT-PCR分析6个Tet-On 3G-Cas9-阳性HEK293稳定细胞系中Cas9的诱导表达情况。将HEK293细胞分别接种至2个孔(12孔板),以AAVS1-sgRNA慢病毒(MOI=5)进行转导。转导8小时后,添加0.5 μg/ml强力霉素至其中一孔诱导培养6天。6天后采用Guide-it Mutation Detection Kit (Code No. 631443)检测AAVS1基因编辑效率。图A.通过qRT-PCR方法检测每个细胞克隆分别在未经诱导(-Dox)和经过诱导(+Dox)的情况下Cas9蛋白质的表达情况。未经诱导和经过诱导的细胞的Ct值和ΔCt值标注在相对应一栏,计算出来的表达倍数差异标注在右侧一栏。多个细胞克隆的检测结果显示,在所检测的细胞克隆中1号克隆(绿色数字)具有最好的诱导性能,只有3号克隆(红色数字)在没有强力霉素诱导的情况下Cas9也会有所表达而且诱导性能较差。图B. Guide-it解离酶分析实验检测未经诱导(–)和经过诱导(+)的细胞克隆中AAVS1基因编辑效率。亲本细胞(未转导细胞)检测结果显示未经诱导和经过诱导的细胞所产生的片段大小是等同的。而经过诱导的稳转细胞系的检测结果显示产生了较小的基因片段,这说明在所检测的细胞克隆中都发生了AAVS1基因编辑现象。3号克隆在未经诱导的情况下也可以观察到剪切产物,这一点与qRT-PCR检测结果是相一致的。 |
| |
 |
| |
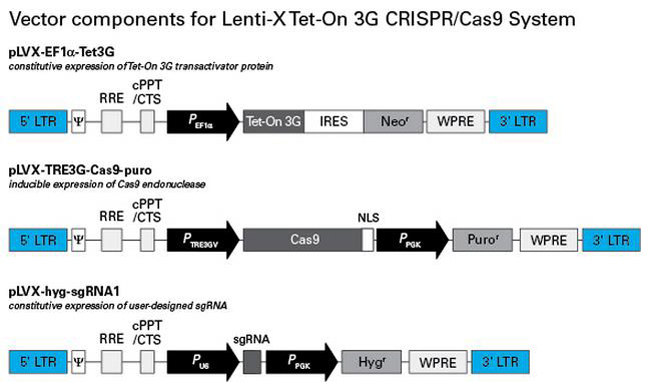
图3. Lenti-X Tet-On 3G CRISPR/Cas9系统载体组成
pLVX-EF1a-Tet3G载体编码表达Tet-On 3G转录激活蛋白质,由组成型启动子EF-1 alpha启动表达。与常用的CMV启动子相比,EF-1 alpha启动子在某些细胞类型(包括各种干细胞类型)中不易被沉默,所建立的诱导细胞系适用于长期使用。Tet-On 3G是由Tet-On Advanced转录激活蛋白质修饰而来,具有更高的强力霉素反应灵敏度。pLVX-TRE3G-Cas9-puro载体由诱导型启动子PTRE3GV启动表达经过优化的Cas9核酸酶。pLVX-TRE3G-Cas9-puro载体上的Cas9序列来源于杆菌属酿脓链球菌,进行了密码子优化以适用于哺乳动物细胞表达,另外在Cas9序列C端还引入了核定位信号(NLS)。pLVX-hyg-sgRNA1载体由组成型人U6启动子编码表达sgRNA(由用户设计并插入)。 |
| |
 |
| |
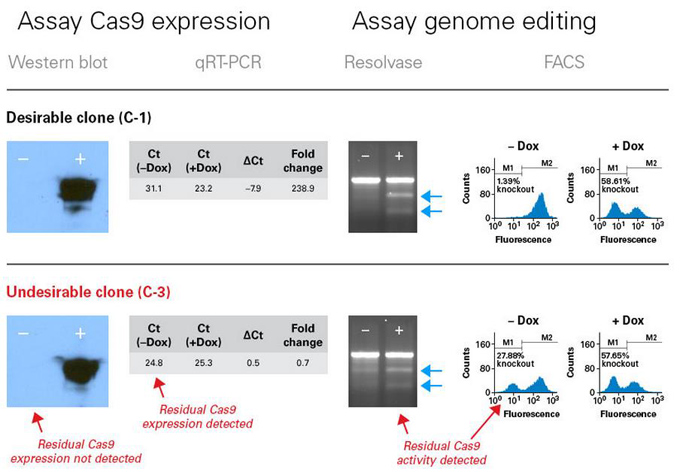
图4.为可诱导型基因编辑选择优质的细胞克隆
通过分析Cas9表达情况或者分析未诱导的或者经过诱导的细胞群基因编辑情况来筛选优质的细胞克隆。虽然通过Western blot检测Cas9蛋白质表达情况有助于预筛选细胞克隆,但是CRISPR/Cas9介导的基因编辑是非常高效的,即使在通过Western blot检测不到Cas9蛋白质表达的情况下,在相应的细胞克隆中仍然有可能发生基因编辑现象。我们建议通过qRT-PCR方法来筛选Cas9背景表达量较低的细胞克隆,以避免在没有添加强力霉素的情况下发生基因编辑现象。图4上面一行显示的是优质细胞克隆(C-1)的检测数据,经过诱导的C-1细胞中Cas9蛋白质表达情况良好(Western blot,+),Cas9 mRNA背景表达水平非常低(qRT-PCR)。和未经诱导的细胞(-或者-Dox)相比,经过诱导的细胞(+或者+Dox)中Cas9的诱导表达使得基因编辑发生的频率更高,解离酶分析实验中小片段(蓝色箭头)的出现,FACS检测结果显示较大比例的细胞出现在“knockout”范围而未经诱导的细胞中基因编辑水平非常低都可以证实这一点。图4下面一行显示的是非优质细胞克隆(C-3)的检测数据,在未经诱导的细胞克隆(-)中即使通过Western blot没有检测到Cas9蛋白质的表达,但依然可以检测到Cas9 mRNA的表达(qRT-PCR)和基因编辑现象(解离酶,FACS)。 |
| |
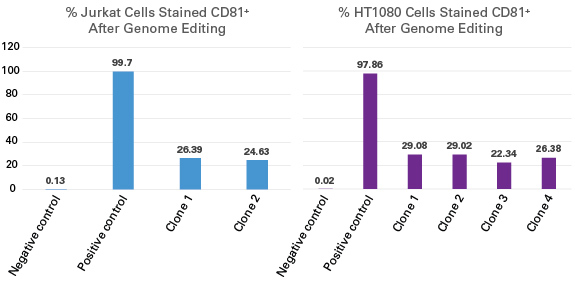 |
| |
| 图5. LVX-hyg-CD81-sgRNA转导Jurkat或者HT1080细胞后采用潮霉素筛选稳定整合细胞系。之后采用LVX-puro-Cas9转导筛选获得的稳定细胞克隆,并采用嘌呤霉素再次进行筛选,通过FACS方法检测CD81敲除效率。以抗CD81抗体处理的未经Cas9转导的亲代细胞作为阳性对照,而未做抗体处理的亲代细胞作为阴性对照。 |
| |
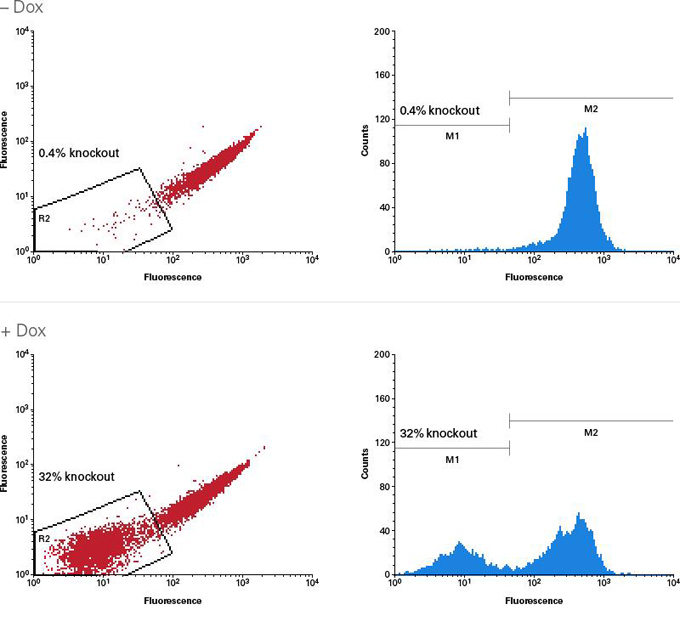 |
| |
图6. 诱导敲除Jurkat细胞中CD81基因
按照实验手册操作流程建立Cas9背景表达较低的Tet-On 3G-Cas9-阳性Jurkat细胞,并以CD81-sgRNA慢病毒(MOI=5)连续转导两次。将成功转导的细胞接种至2个孔(12孔板)中并在其中一孔中添加0.5 μg/ml强力霉素(+Dox)诱导培养7天。采用FITC抗人CD81抗体进行检测并通过FACS进行分析,分析结果显示在未经强力霉素诱导的细胞(-Dox; top)中只有一小部分的细胞(0.4%)发生了基因编辑现象,而经过强力霉素诱导的细胞(+Dox; bottom)中发生CD81基因编辑的比例为32%。 |
| |
| ■ 产品组份 |
Lenti-X CRISPR/Cas9 System (Code No.632629)
· pLVX-hyg-sgRNA1 Vector (Linear) (Code No. 632632,不单独销售)
· pLVX-puro-Cas9 Vector(Code No. 632631)
· Stellar Competent Cells(Code No. 636763)
· Guide-it Ligation Components v2 (Code No. 632615,不单独销售)
· Lenti-X Packaging Single Shots(Code No. 631275,不单独销售)
Lenti-X Tet-On 3G CRISPR/Cas9 System (Code No. 632633)
· pLVX-hyg-sgRNA1 Vector (Linear)
· pLVX-TRE3G-Cas9-puro Vector Set
· pLVX-EF1a-Tet3G Vector
· Stellar Competent Cells
· Guide-it Ligation Components v2
· Lenti-X Packaging Single Shots
pLVX-hyg-sgRNA1 Vector System (Code No. 632630)
· pLVX-hyg-sgRNA1 Vector (Linear) (Code No. 632632,不单独销售)
· Guide-it Ligation Components v2 (Code No. 632615,不单独销售)
· Stellar Competent Cells(Code No. 636763) |
| |
| |
产品详情请点击: |
| |









.png)
.png)
.png)
.png)
.png)
.png)
.png)





