去端肽胶原,蜂窝海绵
Atelocollagen Honeycomb
- 产品特性
- 相关资料
- Q&A
- 参考文献
3D培养和3D支架组织工程研究的有用工具
去端肽胶原,蜂窝海绵
Atelocollagen Honeycomb
◆背景
“蜂窝”胶原海绵具有方向统一、均匀的孔(200-400微米),细胞可以穿透并在其中增殖密集地排列。这种结构有利于营养物质到海绵内为细胞做准备供应,并释放代谢废物和生化产物。细胞能够增殖且填充管腔,形成均匀的细胞团。
|
去端肽胶原蜂窝海绵 Atelocollagen Honeycomb Sponge (KOU-CSH-10) 为2毫米的立方体,应用于3D细胞 培养物和高密度细胞培养基组织工程细胞支架 |
去端肽胶原蜂窝海绵 Honeycomb Disk 96 (KOU-CSH-96)直径为6毫米圆盘形, 适用于96孔和高通量筛选细胞培养。 |
|
KOU-CSH-10 : stereoscopic microscope image 立体显微镜图像 |
KOU-CSH-96 : stereoscopic microscope image 立体显微镜图像 |
|
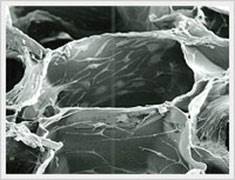
Electron microscope image of Honeycomb sponge 蜂窝海绵的电子显微图像 |
Electron microscope image of mouse fibroblast cell culture in 'Honeycomb collagen sponge 蜂窝胶原海绵小鼠成纤维细胞培养的电子显微镜图像 |
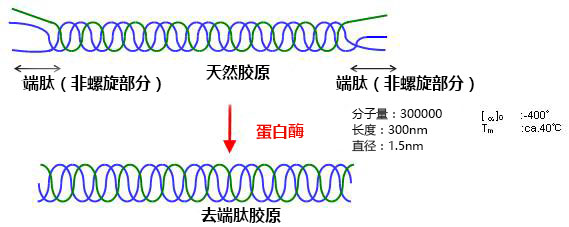
◆去端肽胶原的特点
去端肽胶原是由蛋白酶溶解的胶原,但是它的物理性质几乎与天然未加溶的胶原蛋白相同。而去端肽胶原更具有优越的特性。
◆特点与优点
“蜂窝”胶原海绵由高度纯化I型去端肽胶原制备(牛皮来源),并且可以通过胶原酶降解。
◆应用
3D培养
组织工程3D支架研究
◆使用实例
实例 1
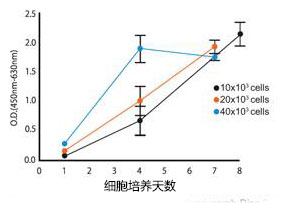
NG1RGB人成纤维细胞在蜂窝圆盘(KOU-CSH-96)
|
|
饲养层细胞/孔(×103) |
附着细胞于蜂窝圆盘96(×103) |
|
10 |
2.2 |
|
|
20 |
5.3 |
|
|
40 |
8.6 |
|
|
细胞增殖:如图所示,在蜂窝圆盘96培养孔中接种。 细胞增殖通过NADH依赖性燃料(WST-8)测定OD值。 |
细胞附着:圆盘培养如图所示,培养一天后转移至新培养孔,并测定细胞数,显示20%的细胞附着。 |
|
实例 2
胚体在蜂窝海绵支架体内移植后的胚体致畸移植
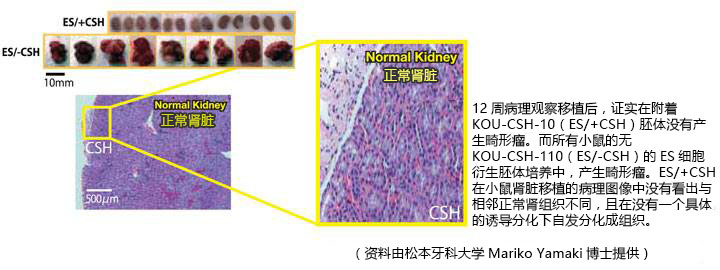
小鼠肾脏在海绵蜂窝支架移植(EB/+ CSH)胚体移植后12周后,没有形成畸胎瘤的迹象,而无KOU-CSH-10(ES/-CSH)的所有小鼠胚体培养产生畸胎瘤。组织学上,移植ES /+ CSH与相邻的主肾组织没有明显区别,表明没有具体的诱导自发分化难以区分。
方法:板中培养小鼠胚胎干(ES)细胞进行胰蛋白酶处理,通过尼龙网过滤,接种到96孔板(1×10^4细胞/孔),培养5天,形成胚状体(EB)。当EB与蜂窝海绵(KOU-CSH-10)混合,EB迅速、均匀融入KOU-CSH-10的矩阵中。EB /+ CSH复合物移植到6周龄小鼠的肾筋膜。
实例 3
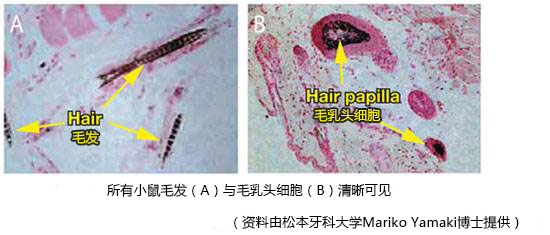
体内小鼠胚胎干/间质细胞镶嵌球移植KOU-CSH-10支架后新生毛发。
方法:小鼠ES细胞和小鼠胚胎间充质细胞(MDU1)共培养以产生两种细胞的镶嵌球体。镶嵌球体与KOU-CSH-10去端肽胶原蜂窝海绵混合,在6周龄小鼠的背部肌肉移植。
<参考文献>
1. Suzuki T, et al. Growth inhibition and differentiation of cultured smooth muscle cells depend on cellular crossbridges across the tubular lumen of type I collagen matrix honeycombs. (2009) Microvasc Res. 77(2):143-149.
◆相关产品
细胞培养胶原:AteloCell
Atelocollagen, Native collagen
去端肽胶原,天然胶原
Atelocollagen powder
去端肽胶原粉末
组织培养胶原溶液是KOKEN(东京)生产的高纯度的胶原溶液,先进的实验室生成,优良的品质控制。
[KOU-IPC-30, KOU-IPC-50, IAC-30, IAC-50, KOU-CLP-01]
Atelocollagen, Eagle's MEM, Hanks' Medium, DMEM
Atelocollagen, Eagle's MEM, DMEM 和 RPMI是用于培养的高纯度胶原溶液。
[KOU-MEN-02, KOU-DME-02, KOU-DME-02H, KOU-RPM-02]
Collagen microspheres
胶原微球
胶原微球用来源于牛皮的I型端肽胶原制备的细胞培养基材。该产品可用于培养,如成纤维细胞,上皮细胞和成骨细胞,并已被证明在细胞培养物的长期维持有效。
[KOU-MIC-00]
Atelocollagen, Honeycomb sponge for cube-shaped and 96-well plate
去端肽胶原,蜂窝海绵立方体和96孔板
蜂窝”胶原海绵由高纯度的牛皮来源I型去端肽胶原制备,并且可以通过胶原酶降解。
[KOU-CSH-10, KOU-CSH-96]
Atelocollagen sponge, Collagen sponge for 35mm culture dish and <90mm × 80mm × 5mm>
去端肽胶原海绵,35mm培养盘与<90mm × 80mm × 5mm >胶原海绵
胶原海绵为3D细胞培养开发的一种胶原的产品。
[KOU-CS-35,KOU-CLS-01]
Atelocollagen sponge, MIGHTY
去端肽胶原海绵,MIGHTY
MIGHTY是强力的胶原海绵,即使施加30kPa(单次)的压缩负荷也不会崩溃。
[KOU-CSM-25, KOU-CSM-50]
Atelocollagen, Permeable membrane for 50mm culture dish
去端肽胶原,50mm培养皿半透膜
Atelocollagen membrane
去端肽胶原膜
胶原膜用高纯度牛皮来源I型去端肽胶原特别制备,用于单层和双层组织培养的研究。
[KOU-MEN-01,KOU-CLF-01]
Atelocollagen, Permeable membrane for 6-well,24-well culture plate, Atelocollagen membrane
去端肽胶原,6孔,24孔培养板,去端肽胶原膜半透膜
由于膜透明,培养时可用显微镜观察细胞。
[KOU-CM-6, KOU-CM-24, KOU-CLF-01]
Type II Collagen II型胶原
Usefull for tissue and cell culture可用于组织和细胞培养[KOU-CL-22]
Atelocollagen coated BETA-TCP scaffold
去端肽胶原涂层BETA-TCP支架
可用于成骨细胞研究[KOU-ACB-05S]

AteloCell 细胞培养胶原.pdf
AteloCell® 系列常见问题(FAQ)
AteloCell® 系列非常适合从日常细胞维持到再生医学基础研究的细胞培养

◆脂肪变性胶原海绵35mm培养皿
Q1:胶原蛋白海绵是否耐热? 它能承受的最高温度是多少? 当温度升高到高于体温的温度时,它会降解吗?
A1:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能
A1:不会变性,除非达到更高的温度。
Q2:这种胶原蛋白的弹性是什么? 它会容易撕裂吗? 它能承受多少重量? 最重要的是,在处理胶原时,我们
Q2:应该注意哪些?
A2:我们没有测试这种产品的弹性。然而,它可能抵抗一定水平的负载,因为这种产品是冻干的不溶性胶原蛋
A2:白。
Q3:它是否适合移植,例如皮肤移植用于伤口愈合?
A3:这不适合移植,因为是没有消除端肽的天然胶原。
Q4:胶原蛋白海绵会溶解吗? 他们如何溶解? 大概需要多长时间才能使它们完全溶解,特别是移植(如皮肤
Q4:细胞)到/入动物模型后? 当胶原溶解时,培养的细胞会发生怎么样的变化?
A4:本产品由不溶性胶原蛋白制成,因此不易溶解。在体内情况下,它会在MMP中溶解。虽然该产品不适合
A4:移植,但有报道称该产品用于体内实验。 根据报告,胶原在8周后从活体中移除。移植胶原被认为将可以
A4:取代移植细胞的胞外基质,直到其消失。
Q5:我们可以用手术刀手动切割胶原片到更小的尺寸吗? 在切割过程中和切割后会造成胶原片/结构/完整性的
Q5:破坏/扭曲/分散吗?
A5:你可以切割胶原板,但如果你使用钝刀,孔结构可能会皱起来。
Q6:细胞会以多大强度/完好地吸附到胶原海绵? 即使在强烈搅拌后细胞能否容易分离?
A6:即使在强烈搅拌后,一旦细胞附着,也不容易分离,除非低粘附性细胞。
Q7:我们如何能够以最小损伤从胶原海绵中分离细胞?
A7:请使用胶原酶分离胶原。
◆胶原海绵,90*80*5mm
Q1:吸水后变形的胶原海绵的厚度是多少?
A1:它将变得略小于5mm。
Q2:一旦吸收水,海绵将变形,除非进行交联。 这方面的交联是什么意思?
A2:考虑通过UV或γ辐射的物理交联或通过交联剂的化学交联。
Q3:胶原海绵是否耐热? 它能承受的最高温度是多少? 当温度升高到高于体温的温度时,它会降解吗?
A3:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能不
A3:会变性,除非达到更高的温度。
Q4:这种胶原蛋白的弹性是什么? 它会容易撕裂吗? 它能承受多少重量? 最重要的是,在处理胶原时,我们
Q4:应该注意哪些?
A4:我们没有测试这种产品的弹性。然而,它可能抵抗一定水平的负载,因为这种产品是冻干的不溶性胶原蛋
A4:白。
Q5:它是否适合移植,例如皮肤移植用于伤口愈合?
A5:这不适合移植,因为是没有消除端肽的天然胶原。
Q6:胶原蛋白海绵会溶解吗? 他们如何溶解? 大概需要多长时间才能使它们完全溶解,特别是移植(如皮肤
Q6:细胞)到/入动物模型后? 当胶原溶解时,培养的细胞会发生怎么样的变化?
A6:本产品由不溶性胶原蛋白制成,因此不易溶解。在体内情况下,它会在MMP中溶解。虽然该产品不适合
A6:移植,但有报道称该产品用于体内实验。 根据报告,胶原在8周后从活体中移除。移植胶原被认为将可以
A6:取代移植细胞的胞外基质,直到其消失。
Q7:我们可以用手术刀手动切割胶原片到更小的尺寸吗? 在切割过程中和切割后会造成胶原片/结构/完整性的
Q7:破坏/扭曲/分散吗?
A7:你可以切割胶原板,但如果你使用钝刀,孔结构可能会皱起来。
Q8:细胞会以多大强度/完好地吸附到胶原海绵? 即使在强烈搅拌后细胞能否容易分离?
A8:即使在强烈搅拌后,一旦细胞附着,也不容易分离,除非低粘附性细胞。
Q9:我们如何能够以最小损伤从胶原海绵中分离细胞?
A9:请使用胶原酶分离胶原。
◆胶原,可渗透膜
Q1:膜是否耐热? 它能承受的最高温度是多少? 当温度升高到高于体温的温度时,它会降解吗?
A1:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能不会
A1:变性,除非达到更高的温度。
Q2:膜的弹性是什么? 它会容易撕裂吗? 它能承受多少重量? 最重要的是,在处理膜时,我们应该注意哪些?
A2:我们没有测试这种产品的弹性。然而,它会容易撕裂,因为这种产品被再加工成薄膜形式。
Q3:它是否适合移植,例如皮肤移植用于伤口愈合?
A3:是的。
Q4:渗透膜会溶解吗? 他们如何溶解? 它需要多长时间才能使它们完全溶解,特别是移植(皮肤细胞)到动物
Q4:模型后? 当胶原溶解时,培养的细胞会发生哪些变化?
A4:我们认为可透膜在移植后约一个月会溶解。
Q5:我们可以用手术刀手动切割膜到更小的尺寸吗? 它会在切割过程中和切割后引起膜结构/完整性的破坏/变
Q5:形/分散吗?
A5:是的,你可以将膜切成更小的尺寸。
Q6:细胞粘附/附着到可渗透膜上的强度/完整性是什么样的,特别是当我们在膜的双面上进行两种不同细胞类型
Q6:的夹心培养时? 即使在强烈搅拌后细胞是否容易分离?
A6:即使在强烈搅拌后,一旦它们附着,细胞也不容易分离,除非低粘附性细胞。
Q7:我们如何能够从双侧膜以最小的损伤分离细胞?
A7:请用刮刀或胶原酶回收细胞。
Q8:如何在膜的两个不同表面上观察两种不同的细胞类型? 我们用镊子翻转? 这种行为是否会造成细胞损伤或
Q8:脱落?
A8:您可以通过相差显微镜观察细胞。然而,难以区分细胞接种于哪一侧。因此,更好的方法是用荧光素标记细
A8:胞并通过荧光显微镜观察。
Q9:可以将膜从50mm培养皿,6孔和24孔培养板上分离下来吗?
A9:可用刀把它分开。
◆胶原,蜂窝海绵
Q1:如何确保培养的细胞粘附在蜂窝海绵上? 我们可以在显微镜下观察吗?
A1:相差显微镜能够观察。
Q2:蜂窝海绵是否耐热? 它能承受的最高温度是多少? 当温度升高到高于体温的温度时,它会降解吗?
A2:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能
A2:不会变性,除非达到更高的温度。
Q3:蜂窝海绵的耐久性是什么? 它能承受多少重量?
A3:我们没有测试这种产品的弹性。然而,它会被负载打破,因为这种产品是冻干低浓度胶原。
Q4:蜂窝海绵会溶解吗? 他们如何溶解? 它需要多长时间才能使它们完全溶解,特别是移植(如皮肤细胞)
Q4:到/入动物模型后? 当蜂窝海绵溶解时,培养细胞会发生哪些变化?
A4:移植后约一个月,海绵会溶解。
Q5:我们可以用手术刀手动切割蜂窝海绵到更小的尺寸(更薄)吗? 在切割过程中和切割后,是否会导致海
Q5:绵结构的破坏/变形/分散?
A5:你可以切割胶原板,但如果你使用钝刀,孔结构可能会皱起来。
Q6:细胞粘附/附着到蜂窝海绵上的强度/完整性如何?即使在强烈搅拌后细胞是否容易分离?
A6:即使在强烈搅拌后,一旦它们附着,细胞也不容易分离,除非低粘附性细胞。
Q7:可以通过胶原酶处理,简便地收获细胞。处理后会影响细胞活力吗?有何处理方案?
A7:请加胶原酶至终浓度为0.1%,溶解约30分钟。如果你担心细胞损伤,提高胶原酶浓度和减少处理时间。
◆羊毛脂海绵(MIGHTY)
Q1:MIGHTY海绵是否耐热? 它能承受的最高温度是多少? 当温度升高,例如高于体温时,它会降解吗?
A1:我们没有测量这种产品的耐热性。以下信息供您参考,由于液体胶原变性在40°C左右,海绵型胶原可能
A1:不会变性,除非达到更高的温度。
Q2:MIGHTY海绵会溶解吗? 他们如何溶解? 它需要多长时间才能使它们完全溶解,特别是移植(如皮肤细
Q2:胞)到/入动物模型后? 当MIGHTY溶解时,培养的细胞会发生哪些变化?
A2:因为MIGHTY海绵是高强度海绵,它难以溶解。有一个数据表明MIGHTY海绵移植后至少3个月内不会溶解。
Q3:我们可以用手术刀手动切割MIGHTY海绵到更小的尺寸吗? 在切割过程中和切割之后,是否会导致MIGHTY
Q3:结构的破裂/变形/分散? 在切割过程中是否有任何的推荐步骤或预防措施?
A3:当它是膨胀状态,你可以切割MIGHTY海绵。然而,刀切割海绵后,可能会有切口,因为这是一种高强度的海绵。
Q4:细胞粘附/附着到MIGHTY海绵上的强度/完整性?即使在强烈搅拌后细胞也能很容易分离吗?
A4:即使在强烈搅拌后,一旦它们附着,细胞也不容易分离,除非低粘附性细胞。
Q5:我们如何将细胞以最小损伤从MIGHTY海绵中分离?
A5:因为MIGHTY海绵是高强度的,所以难以从海绵中回收活细胞。另一方面,在均质化之后回收核苷酸或蛋白质
A5:是可行的。
◆胶原微球
Q1:微球胶原蛋白的上清液/溶液是什么?
A1:PBS
Q2:如何确保培养的细胞粘附到微球? 我们可以在显微镜下观察吗?
A2:你可以通过相差显微镜观察。
◆胶原涂层B-TCP(B-磷酸钙)支架
Q1:这个支架的厚度是多少?
A1:1.0±0.1 mm
Q2:支架是否耐热? 它能承受的最高温度是多少?当温度升高,例如高于体温时,它会降解吗?
A2:β-TCP支架可以耐高温,但是涂覆的胶原在40℃左右变性。
Q3:支架的弹性如何? 它会容易撕裂/破裂吗? 它能承受多少重量? 最重要的是,在处理胶原时,我们应该注
Q3:意哪些?
A3:我们没有测试这种产品的弹性。然而,我们认为支架是来自β-TCP,它可以承受一定负载。
Q4:它适合移植吗?
A4:是。 但本产品设计用于骨形成测定。
Q5:支架会溶解吗? 他们如何溶解? 需要多长时间才能使它们完全溶解,特别是移植到动物模型之后? 当支架
Q5:溶解时,培养的细胞会发生哪些变化?
A5:很难溶解,因为这个产品是由β-TCP组成。
Q6:我们可以用手术刀手动切割支架到更小的尺寸吗? 在切割过程中和切割后会引起支架结构的破坏/变形/分散
Q6:吗?
A6:很难切割,因为这个产品是由β-TCP组成。
Q7:细胞粘附/附着到支架上的强度/完整性如何?即使在强烈搅拌后细胞是否容易分离?
A7:即使在强烈搅拌后,一旦细胞附着,也不容易分离,除非低粘附性细胞。
Q8:我们如何能够以最小的损害从支架上分离细胞?
A8:请使用胶原酶分离胶原。
Atelocollagen, Honeycomb sponge
Product number : KOU-CSH-10, KOU-CSH-96
<References>
1. Ishii I, et al. Correlation between antizyme 1 and differentiation of vascular smooth muscle
cellscultured in honeycomb-like type-I collagen matrix. Amino Acids. (2012) Feb;42(2-3):565-75.
2. Ishii I, et al. Histological and functional analysis of vascular smooth muscle cells in a novel culture
system with honeycomb-like structure. At herosclerosis. (2001) Oct;158(2):377-84.
3. Mariko Yamaki: in vitro and de novo generation of hair from mosaic spheres formed jointly from ES
and mesenchymal cells. The Japanese Society for Regenerative Medicine magazine. (2009)
8(2):91-97.
4. Mariko Yamaki: Artificial extracellular matrix of type I collagen can suppress the tumorigenetic
potential of mouse embryonic stem cells. The Japanese Society for Regenerative Medicine
magazine. (2009) 8(1):109-114.
5. Suzuki T, et al. Growth inhibition and differentiation of cultured smooth muscle cells depend
on cellular crossbridges across the tubular lumen of type I collagen matrix honeycombs. (2009)
Microvasc Res. 77(2):143-149.
6. Fukui N, et al. Bone tissue reaction of nano-hydroxyapatite/collagen composite at the early stage of
implantation. (2008) Biomed Mater Eng. 18(1):25-33.
7. Fukushima K, et al. The axonal regeneration across a honeycomb collagen sponge applied to the
transected spinal cord. (2008) J Med Dent Sci. 55(1):71-79.
8. Kakudo N, et al. Bone tissue engineering using human adipose-derived stem cells and honey comb
collagen scaffold. (2008) J Biomed Mater Res A. 84(1):191-197.
9. Saeki K, et al. Highly efficient and feeder-free production of subculturable vascular endothelial cells
from primate embryonic stem cells.(2008) J Cell Physiol. 217(1):261-280
10.Takeuchi R, et al. Low-intensity pulsed ultrasound activates the phosphatidylinositol 3 kinase/Akt
pathway and stimulates the growth of chondrocytes in three-dimensional cultures: a basic science
study. (2008) Arthritis Res Ther. 10(4):R77.
11.Hidetsugu T, et al. Mechanism of bone inducti on by KUSA/A1 cells using atelocollagen honeycomb
scaffold. (2007) J Biomed Sci. 14(2):255-263.
12.Rodriguez AP, Missana L, Nagatsuka H, et al.: Efficacy of atelocollagen honeycomb scaffold
in bone formation using KUSA/A1 cells. J Biomed Mater Res A. (2006) 77(4):707-717.
13.George J, et al. Differentiation of mesenchymal stem cells into osteoblasts on honeycomb collagen
scaffolds. (2006) Biotechnol Bioeng. 95(3):404-411.
14.Imamura T, et al. Embryonic stem cell-derived embryoid bodies in three-dimensional culture
system form hepatocyte-like cells in vitro and in vivo. (2004) Tissue Eng. 10(11-12):1716-1724.
15.Itoh H, et al. A honeycomb collagen carrier for cell culture as a tissue engineering scaffold.(2001) Artif
Organs. 25(3):213-217.
16.Moriyama T, et al. Development of composite cultured oral mucosa utilizing collagen sponge
matrix and contracted collagen gel: a preliminary study for clinical applications. (2001) Tissue Eng.7(4):
415-427.
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 产品价格 |
| KOU-CSH-10 | Atelocollagen Honeycomb sponge | 100MG | ||
| KOU-CSH-96 | Atelocollagen Honeycomb Disc 96 | 25PC |