质谱级赖氨酰肽链内切酶
Lysyl Endopeptidase
- 产品特性
- 相关资料
- Q&A
- 参考文献
质谱级赖氨酰肽链内切酶

Lysyl Endopeptidase
本产品是质谱分析前处理时最常用的蛋白分解酶即赖氨酰肽链内切酶,该酶可以特异性切除赖氨酸基团C末端的多肽,可用于蛋白测序分析和Lys-X化合物的酶合成。若同时使用赖氨酰肽链内切酶和胰酶,可更好地切断赖氨酸 基团的多肽,增加多肽的数量。产品已按照使用习惯做成小包装,是方便使用的冷冻干燥品。
来源:细菌
外观:冻干粉(包含2mmol/L Tris-HCl缓冲液,pH8)
活性:0.03~0.07AU/vial
分子量:27,000(琼脂糖过滤),30,000(SDS-PAGE)
溶解性:溶于水或缓冲液
稳定性:溶解于pH值5.0-12.0的Tris缓冲液中,可在4℃稳定保存2年;在pH值6.0-11.0 30℃时能稳定保存,但温度超过50℃时不稳定。
最适pH值:9.0~9.5
等电点:6.9~7.0
底物特异性:
可水解底物——Tos-Lys-OMe,Bz-Lys-NH2,Bz-Lys-pNA,Lys-pNA
不可水解底物——Bz-Arg-NH2,Bz-Arg-pNA,Arg-pNA
抑制剂:DFP,PMSF,TLCK
◆特点

● 高特异性、高蛋白质消化率、适用于蛋白质谱分析
● 提高裂解效率、增加肽段数量
● 根据使用量特意制备小包装,方便使用
◆应用
分别采用胰蛋白酶(Tp)、赖氨酰肽链内切酶(Lep) 和Tp与Lep联用进行胶内酶切的效果比较。
牛血清蛋白BSA 的条带(100ng) 通过SDS-PAGE 获得,然后分别用Tp、Lep和Lep+Tp进行酶切,再用MALDI-TOFMS法进行分析。
这些蛋白酶的实验效果见下表。
表 1:Tp、Lep和Lep+Tp的结果对照
这些结果表明Lep酶解的错误裂解率最低。Tp酶解时加入Lep后,错误裂解率有所降低,同时,可以鉴定出更多的多肽。
|
Tp |
Lep |
Lep +Tp |
|
|
裂解位点 |
精氨酸和赖氨酸的C端 |
赖氨酸的C端 |
精氨酸和赖氨酸的C端 |
|
错误裂解率 ( 错误裂解所占比例 ) |
多(8%) |
很少(0%) |
少(3%) |
|
鉴定出的多肽数量 |
17 |
19 |
22 |
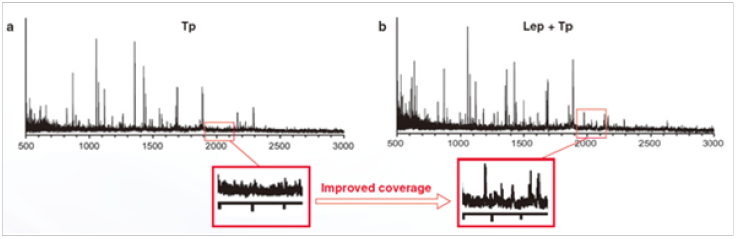
胰蛋白酶 (Tp)( 图 a) 和赖氨酰肽链内切酶 (Lep)+Tp ( 图 b) 酶切后的质谱结果对照图。
Lep+Tp酶切后,可以在m/z=2000时得到吸收峰,而单独的Tp酶切在m/z=2000时没有吸收峰。该结果表明Lep可以提高测序覆盖度。
( 数据由大阪医疗中心和妇婴健康研究所Y. Wada博士提供 )
赖氨酰肽链内切酶
赖氨酰肽链内切酶,最初由Masaki 等人从土壤细菌中分离得到。该酶可以特异性剪切赖氨酸残基C 末端和S-氨乙基半胱氨酸残基的肽键,用于蛋白测序和Lys-X 化合物的酶催化合成。该酶稳定性高,在4M 尿素或0.1%SDS 溶液中30℃孵育6小时之后,仍然拥有完整的生物活性。
|
外观 |
冻干粉(包含ca. 10% Tris-HCl buffer,pH 8) |
活性 |
见包装 |
|
分子量 |
27,000(凝胶过滤);30,000 (SDS-PAGE) |
溶解性 |
易溶于水或缓冲液 |
|
最佳pH |
9.0-9.5(酰胺酶的最佳活性pH) |
等电点 |
6.9-7.0 |
|
抑制剂 |
DFP、PMSF、TLCK |
来源 |
细菌 |
|
稳定性 |
溶于pH 值5.0-12.0 的缓冲液中,可于4℃稳定保存。溶于pH值6.0-11.0的缓冲液中,可于30℃稳定保存,但是50℃及以上不稳定。 |
||
|
单位定义 |
一单位酰胺酶(AU) 指在30℃ pH9.5 时每分钟产生1μmol对硝基苯胺所需的酶量。 |
||
|
底物特异性 |
水解底物:Tos-Lys-Ome、Bz-Lys-NH2、Bz-Lys-pNA、Lys-pNA |
||
|
非水解底物:Bz-Arg-NH2、Bz-Arg-pNa、Arg-pNA |
|||
实验方法:
1. 试剂:
A.0.2 mol/L AMP 缓冲液,pH值9.5
溶解4.2g的2-氨基-2-甲基-1,3-丙二醇于150 mL的水中,加入1 mol/L HCl调pH值至9.5,再加水使体积至200 mL。
B.2.5 mmol/L 底物溶液
溶解22.6 mg的N-苯甲酰基-DL-精氨酰-4-硝基苯胺盐酸盐于20 mL水中。
C. 2 mmol/L Tris-HCl缓冲液,pH8
溶解0.24 mg的2-氨基-2-羟甲基-1,3-丙二醇于900mL水中,加入0.1 mol/L HCl调pH值至8,再加水使体积至1L。
D. 酶溶液
溶解1vial的赖氨酰肽链内切酶于1 mL的溶剂C中,可直接加入。
E.终止溶液
将55 mL水和45 mL乙酸混合均匀。
2. 步骤
|
试剂 |
检测样品 |
空白对照 |
|
A |
2.6 mL |
2.6 mL |
|
B |
0.3 mL |
0.3 mL |
|
30℃预培养5分钟 |
||
|
D |
0.1 mL |
– |
|
C |
– |
0.1 mL |
|
立即混合均匀,30℃预培养25分钟 |
||
|
E |
1.0 mL |
1.0 mL |
3. 单位的定义
酰胺酶单位是指30℃ pH9.5时,每分钟产生1 umol对硝基苯胺的酶量。
AU/vial = [(a-b) / 25] × (1 / 9.62) × (4.0 / 0.1)
a. 检测样品中的吸光度
b. 空白对照中的吸光度
胶内酶切的实验操作流程
用聚硅酮处理的微量离心管和吸管端防止捕获任何蛋白。使用质谱分析用凝胶染色试剂盒,例如银染剂MS试剂盒(产品编号:299-58901)和负凝胶染色MS试剂盒(产品编号:293-57701)
1. 电泳分离蛋白质样品;
2. 从凝胶中切割蛋白质片断并放入微量离心管;
3. 使凝胶脱色(可使用质谱分析用凝胶染色试剂盒中的脱色溶液);
4. 加入300 uL乙腈到试管里,搅拌器振荡30分钟;
5. 去除乙腈,用Parafilm膜覆盖微量离心管。
6. 在Parafilm膜上打出针孔,真空干燥15分钟;
7. 100 uL 10 mmol/L DTT溶解于100 mmol/L 碳酸氢铵,56℃恒温1小时。
8. 室温冷却后,用等量的50mM碘乙酰胺溶解于100 mmol/L 碳酸氢铵,暗处恒温45分钟并涡旋;
9. 用100 uL 100 mmol/L碳酸氢铵洗涤凝胶片段10分钟;
10. 用300 uL乙腈干燥凝胶片段15分钟;
11. 用100 uL 100 mmol/L碳酸氢铵溶胀凝胶片段15分钟;
12. 用300 uL乙腈再次干燥凝胶片段15分钟;
13. 去除液相,真空干燥凝胶片段15分钟;
14. 用100 uL赖氨酸内切酶溶液*在冰水浴中溶胀凝胶片段45分钟;
*赖氨酸内切酶稀释于50 mmol/L Tris-HCl pH 8.5;
15. 去除100 uL赖氨酸内切酶溶液,将凝胶片段放在37℃ 10 uL 50 mmol/L Tris-HCl pH 8.5中过夜;
16. 加入50 uL 20mmol/L碳酸氢铵20分钟内振荡凝胶片段3次抽提多肽;
17. 加入5%甲酸/50%乙腈20分钟内振荡凝胶片段3次抽提多肽;
18. 如果需要用Speed Vac.浓缩多肽;
19. 用ZipTip脱盐和纯化多肽;
20. 如果需要用弱真空浓缩多肽至2 uL;
21. 加入基质进行质谱分析。
注意:根据细菌的生理和形态特征分类,产品来源为水解无色杆菌,但是最近细菌分类学将这种细菌鉴定为产酶溶杆菌。
保存:暗处-20℃保存
规格:20 ug×5vial
相关产品
|
产品编号 |
产品名称 |
规格 |
应用 |
|
202-15951 |
Trypsin, from Porcine Pancreas, Mass Spectrometry Grade 猪胰腺胰蛋白酶质谱级别 |
5×20 μg |
蛋白质组学 |
|
056-05921 |
Endoproteinase Asp-N, Sequencing grade 胞内蛋白酶 Asp-N(测序级别) |
2 μg |
用于测序 |
|
050-05941 |
Endoproteinase Glu-C, Sequencing grade 胞内蛋白酶 Glu-C(测序级别) |
50 μg |
|
|
164-13982 |
V8 Protease [Endoproteinase Glu-C] V8蛋白酶 |
2 mg |
生物化学 |

点击图片打开PDF

赖氨酰肽链内切酶,MS级
产品编号:125-05061
发表文献
[1] Ojima T et al. “Characterization of Halomonas Sp. Strain H11 {alpha}-Glucosidase Activated by Monovalent Cations and Its Application for Efficient Synthesis of {alpha}-D-Glucosylglycerol.” Applied and Environmental Microbiology 78, no. 6 (March 15, 2012): 1836–1845.
[2] Leitner A et al. “Expanding the Chemical Cross-Linking Toolbox by the Use of Multiple Proteases and Enrichment by Size Exclusion Chromatography.”Molecular and Cellular Proteomics 11, no. 3 (March 1, 2012): M111.014126.
[3] Goetze A et al. “Rates and Impact of Human Antibody Glycation in Vivo.” Glycobiology 22, no. 2 (February 1, 2012): 221–234.
[4] Thingholm, T et al. “Characterization of Human Myotubes From Type 2 Diabetic and Nondiabetic Subjects Using Complementary Quantitative Mass Spectrometric Methods.” Molecular and Cellular Proteomics 10, no. 9 (September 1, 2011): M110.006650.
[5] Shoji M et al. “walK and clpP Mutations Confer Reduced Vancomycin Susceptibility in Staphylococcus Aureus.” Antimicrobial Agents and Chemotherapy 55, no. 8 (August 1, 2011): 3870–3881.
[6] Kubota T et al. “Quantitative Proteomic Analysis of Chromatin Reveals That Ctf18 Acts in the DNA Replication Checkpoint.”Molecular and Cellular Proteomics 10, no. 7 (July 1, 2011): M110.005561.
[7] Lee E et al. “The Steady-State Repertoire of Human SCF Ubiquitin Ligase Complexes Does Not Require Ongoing Nedd8 Conjugation.” Molecular and Cellular Proteomics 10, no. 5 (May 1, 2011): M110.006460.
[8] Shirai Y et al. “Direct Binding of RalA to PKC{eta} and Its Crucial Role in Morphological Change During Keratinocyte Differentiation.” Molecular Biology of the Cell 22, no. 8 (April 15, 2011): 1340–1352.
[9] Liu D et al. “N-terminal Glutamate to Pyroglutamate Conversion in Vivo for Human IgG2 Antibodies.” Journal of Biological Chemistry 286, no. 13 (April 1, 2011): 11211–11217.
[10] Shen H et al. “Constitutive Activated Cdc42-associated Kinase (Ack) Phosphorylation at Arrested Endocytic Clathrin-coated Pits of Cells That Lack Dynamin.” Molecular Biology of the Cell 22, no. 4 (February 15, 2011): 493–502.
[11] Keinath N et al. “PAMP (Pathogen-associated Molecular Pattern)-induced Changes in Plasma Membrane Compartmentalization Reveal Novel Components of Plant Immunity.” Journal of Biological Chemistry 285, no. 50 (December 10, 2010): 39140–39149.
[12] Maeda T et al. “Purification, Characterization and Amino Acid Sequence of a Novel Enzyme, D-threo-3-hydroxyaspartate Dehydratase, from Delftia Sp. HT23.” Journal of Biochemistry 148, no. 6 (December 1, 2010): 705–712.
[13] Rajagopal C et al. “Secretion Stimulates Intramembrane Proteolysis of a Secretory Granule Membrane Enzyme.” Journal of Biological Chemistry 285, no. 45 (November 5, 2010): 34632–34642.
[14] Sato H et al.“Novel Isonitrile Hydratase Involved in Isonitrile Metabolism.”Journal of Biological Chemistry 285, no. 45 (November 5, 2010): 34793–34802.
[15] Manno S et al. “ATP-dependent Mechanism Protects Spectrin Against Glycation in Human Erythrocytes.” Journal of Biological Chemistry 285, no. 44 (October 29, 2010): 33923–33929.
[16] Matsumoto T et al. “Proteomic Analysis Identifies Insulin-like Growth Factor-binding Protein-related Protein-1 as a Podocyte Product.” Renal Physiology 299, no. 4 (October 1, 2010): F776–784.
[17] Sury M et al. “The SILAC Fly Allows for Accurate Protein Quantification in Vivo.” Molecular and Cellular Proteomics 9, no. 10 (October 1, 2010): 2173–2183.
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 产品价格 |
| 125-05061 | Lysyl Endopeptidase, MS Grade 赖氨酰肽链内切酶,MS级 |
20μg×5 | 质谱级 | – |
| 125-02543 | Lysyl Endopeptidase (R) 赖氨酰肽链内切酶 |
1vial(2AU) | for Biochemistry | – |
| 129-02541 | Lysyl Endopeptidase (R) 赖氨酰肽链内切酶 |
1vial(10AU) | for Biochemistry | – |
